1.5 Hukum-hukum mengenai materi dan energi [kembali]
1.5.1 Hukum pelestarian energi
Karena tidak ada energi yang diciptakan maupun dimusnahkan, energy total sistem sebelum reaksi sama dengan energy total setelah reaksi.
1.5.2 Hukum pelestarian massa
Pada abad 18, dikembangkan metoda eksperimen untuk mengukur volume gas, menimbang gas, cairan dan zat padat; dan melakukan reaksi kimia sedemikian sehingga bobot pereaksi dan hasil reaksi dapat diukur dengan cermat. Menurut salah satu hukum ini massa tak dapat diciptakan maupun dimusnahkan dalam perubahan materi apa saja. Bobot pereaksi dan hasil reaksi tidaklah sama secara mutlak.
1.5.3 Hukum susunan pasti
Suatu senyawa murni selalu tersusun dari unsure-unsur yang tetap, yang bergabung dengan perbandingan bobot yang pasti. Fakta bahwa suatu senyawa mempunyai susunan tertentu yang selalu berulang bermanfaat dalam menentukan kapal berlangsung suatu perubahan kimia.
Batasan hukum susunan pasti
Pihak-pihak utama mengenai hukum ini adalah dua ahli kimia Prancis, Joseph Proust dan Claude Berthollet. Proust berkeras bahwa hukum itu berlaku dengan cermat untuk zat-zat murni. Berthollet yang lebih mengandalkan hasil karya laboratorium orang lain , mengemukakan bahwa susunan suatu senyawa bergantung pada kondisi pembuatannya. Lebih dari seabad setelah kemenangan Proust, hukum susunan diterima tanpa protes. Seiring perkembangan zaman kita tau bahwa banyak senyawa padat susunan tidak pasti. Mayoritas memiliki susunan pasti, mereka disebut daltonida. Senyawa padat dengan susunan agak berubah, disebut bertolida.
1.5.4 Hukum perbandingan berganda
Dua unsur dapat bersenyawa membentuk lebih dari satu senyawa. Analisis menunjukkan bahwa meskipun senyawa-senyawa mempunyai susunan bobot yang berlainan, susunan-susunan ini bertalian sederhana . Sebagai suatu contoh khusus, perhatikan dua senyawa biasa antara karbon dan oksigen. Karbon terbakar dalam oksigen terlebih dahulu membentuk gas A, suatu gas yang tidak dapat terbakar, tak bersifat racun dan rapat. Tetapi jika oksigen tidak cukup pada waktu pembakaran akan terbentuk gas B yang mudah terbakar dan bersifat beracun. Suatu analisis terhadap senyawa-senyawa ini menunjukkan bahwa masing-masing gas mempunyai susunan sendiri yang pasti. Dalam gas yang tak dapat terbakar 1,00 g karbon selalu bersenyawa dengan 2,67 g oksigen sedangkan dalam gas yang mudah terbakar 1,00 g karbon selalu bersenyawa dengan 1,33 g oksigen.
Dapat dilihat bahwa angka banding bobot oksigen yang bersenyawa dengan karbon berbobot sama adalah 2:1.
Besi dan klor juga membentuk dua senyawa, zat padat C dan zat padat D Banyaknya klor yang bersenyawa dengan 1,00 g besi dalam zat padat C ialah 1,26 g banyak nya klor yang bersenyawa dengan 1,00 g besi dalam zat padat D adalah 1,89 g.
Bobot klor yang bersenyawa dengan besi berbobot sama, adalah berbanding sebagai 2:3. Fakta ini sebagai hukum perbandingan berganda. Bila dua unsur senyawa membentuk lebih dari suatu senyawa dengan suatu bobot tertentu unsure yang lain, berbanding sebagai bilangan bulat sederhana.
1.6 Bukti suatu Reaksi Kimia [kembali]
Tiga macam perubahan selalu menyertai perubahan reaksi. Ketika reaksi berlangsung, pereaksi berubah menjadi hasil- reaksi yang mempunyai (1) sifat, (2) susunan, dan (3) energi dalam yang berlainan.
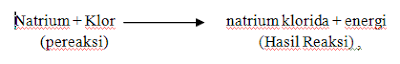
Untuk menggambarkan lebih jauh ketiga perubahan yang menyertai reaksi kimia, perhatikan cara lain untuk membuat natrium klorida, dengan membakar natrium dalam atmosfer klor:
Perubahan sifat, Natrium berupa logam keperakan, lunak yang bereaksi sangat hebat dengan air, dan gas kalor berupa gas hijau- kuning, bersifat racun. Beda dalam sifat tak dapat lebih menyolok: dua bahan kimia yang berbahaya bereaksi menghasilkan sebuah zat yang esensial dalam makanan.
Perubahan komposisi, natrium adalah 100 persen natrium, klor adalah 100 persen klor, natrium klorida adalah suatu senyawa yang mengandung 39,34 persen natrium dan 60,66 persen klor, dilihat dari bobotnya.
Perubahan energi, selama reaksi ini jelas terjadi perubahan energi, karena dipancarkan cahaya dan kalor. Sebagian energi ini diserap oleh wadah dan udara di sekitarnya. Karena reaksi itu eksoterm, natrium klorida pastilah mengandung isi-energi yang lebih rendah daripada natrium dan klor aslinya.
1.7 Teori Dalton [kembali]








Tidak ada komentar:
Posting Komentar